lunes, 22 de noviembre de 2010
sábado, 20 de noviembre de 2010
Práctica Química Ácidos y bases
Sustancias:
Cualquier sustancia liquída que se quiera revisar su PH (20 sustancias)
Materiales:
Bata
Tiras indicadoras de PH
Prodecimiento mete una de las tiras en la sustancia deseada y espera 60 segundos y revisa los colores de tú tira en la caja de las tiras .
Nosotros usamos Hipoclorito de sodio en agua, Pino en agua, Suavizador de telas en agua, Jabón de trastes en agua, Café con leche, Limpiador de pisos, Aceite de Mamey, Perfume, esencia de coco, Tequila, Refresco, Té de manzanilla, Chamoy, Agua de la llave, Jugo de limón, Alcohol, Vainilla, Agua Oxigenada, Jugo de Mango, Cerveza
Si quieres revisar los resultados de estas sustancias descarga aquí la tabla
Cualquier sustancia liquída que se quiera revisar su PH (20 sustancias)
Materiales:
Bata
Tiras indicadoras de PH
Prodecimiento mete una de las tiras en la sustancia deseada y espera 60 segundos y revisa los colores de tú tira en la caja de las tiras .
Nosotros usamos Hipoclorito de sodio en agua, Pino en agua, Suavizador de telas en agua, Jabón de trastes en agua, Café con leche, Limpiador de pisos, Aceite de Mamey, Perfume, esencia de coco, Tequila, Refresco, Té de manzanilla, Chamoy, Agua de la llave, Jugo de limón, Alcohol, Vainilla, Agua Oxigenada, Jugo de Mango, Cerveza
Si quieres revisar los resultados de estas sustancias descarga aquí la tabla
Ácido-Base
Existen varias teorías sobres los ácidos y bases pero las principales son la teoría de ARRHENIUS, LOWRY Y BRONSTED Y LEWIS de las cuales hablaremos a continuación.
ARRHENIUS : fue un químico suizo que estudió en la Universidad de Uppsala en donde investigó las propiedades conductoras de las disoluciones electrolíticas y de eso trato su tesis y pudo concluir que los ácidos como sustancias químicas contenían hidrógeno, y que disueltas en agua producían una concentración de iones hidrógeno o protones, mayor que la existente en el agua pura también dijo que una base como una sustancia que disuelta en agua producía un exceso de iones hidroxilo y que a reacción de neutralización sería: H+ + OH- H2O.
LEWIS: Propuso el concepto más general de ácidos y bases y también introdujo el uso de las fórmulas del electrón el puso pares electrónicos en la escritura de fórmulas químicas es también la base del modelo ácido. El definió al acido como una sustancia capaz de aceptar y compartir un par electrónico y la base es una sustancia capaz de donar y compartir un par electrónico.
CARACTERISTICAS PRINCIPALES DE LOS ACIDOS Y BASES:
La acidez y la basicidad constituyen el conjunto de propiedades características de dos importantes grupos de sustancias químicas: los ácidos y las bases. los ácidos como dadores de protones y las bases como aceptadoras. Los procesos en los que interviene un ácido interviene también su base conjugada, que es la sustancia que recibe el protón cedido por el ácido. Tales procesos se denominan reacciones ácido-base.
Sustancias
PH: Es una medida de la acidez o alcalinidad de una solución el pH indica la concentración de iones hidrónimo presentes en determinadas sustancias las siglas PH significan potencial de hidrogeno.
Logaritmo: en una base dada, es el exponente al cual se debe elevar la base para obtener el número también es la operación aritmética donde dando un número resultante y una base de potenciación, se tiene que hallar el exponente al que hay que elevar la base para conseguir el mencionado resultado. Así como la suma y multiplicación tienen como operaciones opuestas la resta y la división respectivamente, la logaritmación es la operación inversa a la exponenciación.
Soluciones
En química, una disolución (del latín disolutio), también llamada solución, es una mezcla homogénea a nivel molecular o iónico de dos o más sustancias que no reaccionan entre sí, cuyos componentes se encuentran en proporción que varía entre ciertos límites.
Un ejemplo común podría ser un sólido disuelto en un líquido, como la sal o el azúcar disuelto en agua; o incluso el oro en mercurio, formando una amalgama.
Disolvente y soluto
Características generales
Gaseosas
Sólidos en Gases: Existen infinidad de disoluciones de este tipo, pues las podemos encontrar en la contaminación al estudiar los componentes del humo por ejemplo, se encontrará que hay varios minerales disueltos en gases.
Gases en Gases: De igual manera, existe una gran variedad de disoluciones de gases con gases en la atmósfera, como el Oxígeno en Nitrógeno.
Líquidos en Gases: Este tipo de disoluciones se encuentran en las nieblas.
Son mezclas homogéneas: las proporciones relativas de solutos y solvente se mantienen en cualquier cantidad que tomemos de la disolución (por pequeña que sea la gota), y no se pueden separar por centrifugación ni filtración.
Al disolver una sustancia, el volumen final es diferente a la suma de los volúmenes del disolvente y el soluto.4
La cantidad de soluto y la cantidad de disolvente se encuentran en proporciones que varían entre ciertos límites. Normalmente el disolvente se encuentra en mayor proporción que el soluto, aunque no siempre es así. La proporción en que tengamos el soluto en el seno del disolvente depende del tipo de interacción que se produzca entre ellos. Esta interacción está relacionada con la solubilidad del soluto en el disolvente.
Las propiedades físicas de la solución son diferentes a las del solvente puro: la adición de un soluto a un solvente aumenta su punto de ebullición y disminuye su punto de congelación; la adición de un soluto a un solvente disminuye la presión de vapor de éste.
Sus propiedades físicas dependen de su concentración:
Disolución HCl 12 mol/L Densidad = 1,18 g/cm3
Disolución HCl 6 mol/L Densidad = 1,10 g/cm3
Las propiedades químicas de los componentes de una disolución no se alteran.
Sus componentes se separan por cambios de fases, como la fusión, evaporación, condensación, etc.
Tienen ausencia de sedimentación, es decir, al someter una disolución a un proceso de centrifugación las partículas del soluto no sedimentan debido a que el tamaño de las mismas son inferiores a 10 Angstrom ( Å ).
Se encuentran en una sola fase.
Frecuentemente, uno de los componentes es denominado disolvente, solvente, dispersante o medio de dispersión y los demás solutos. Los criterios para decidir cuál es el disolvente y cuáles los solutos son más o menos arbitrarios; no hay una razón científica para hacer tal distinción.1
Se suele llamar disolvente al componente que tiene el mismo estado de agregación que la disolución; y soluto o solutos, al otro u otros componentes. Si todos tienen el mismo estado, se llama disolvente al componente que interviene en mayor proporción de masa,2 aunque muchas veces se considera disolvente al que es más frecuentemente usado como tal (por ejemplo, una disolución conteniendo 50% de etanol y 50% de agua, es denominada solución acuosa de etanol).1 En el caso de dos metales disueltos mutuamente en estado sólido, se considera disolvente a aquél cuya estructura cristalina persiste en la solución; si ambos tienen la misma estructura (ej.: aleaciones paladio-plata), se considera disolvente al metal que ocupa la mayoría de las posiciones en la estructura cristalina.3
Wilhelm Ostwald distingue tres tipos de mezclas según el tamaño de las partículas de soluto en la disolución:2
Dispersiones, suspensiones o falsas disoluciones: cuando el diámetro de las partículas de soluto excede de 0,1 μm
Dispersoides, coloides o disoluciones coloidales: el tamaño está entre 0,001 μm y 0,1 μm
Dispérsidos o disoluciones verdaderas: el tamaño es menor a 0,001 μm
Estas últimas se clasifican en:
Disoluciones con condensación molecular: la partícula dispersa está formada por una condensación de moléculas.
Disoluciones moleculares: cada partícula es una molécula.
Disoluciones iónicas: la partícula dispersa es un ion (fracción de molécula con carga eléctrica).
Disoluciones atómicas: cada partícula dispersa es un átomo.
Líquidas
Sólidos en Líquidos: Este tipo de disoluciones es de las más utilizadas, pues se disuelven por lo general pequeñas cantidades de sustancias sólidas (solutos) en grandes cantidades líquidas (solventes). Ejemplos claros de este tipo son la mezcla del Agua con el Azúcar, también cuando se prepara un Té, o al agregar Sal a la hora de cocinar.
Gases en Líquidos: Por ejemplo, Oxígeno en Agua.
Líquidos en Líquidos: Ésta es otra de las disoluciones más utilizadas. Por ejemplo, diferentes mezclas de Alcohol en Agua (cambia la densidad final); un método para volverlas a separar es po
Líquidas
Sólidos en Líquidos: Este tipo de disoluciones es de las más utilizadas, pues se disuelven por lo general pequeñas cantidades de sustancias sólidas (solutos) en grandes cantidades líquidas (solventes). Ejemplos claros de este tipo son la mezcla del Agua con el Azúcar, también cuando se prepara un Té, o al agregar Sal a la hora de cocinar.
Gases en Líquidos: Por ejemplo, Oxígeno en Agua.
Líquidos en Líquidos: Ésta es otra de las disoluciones más utilizadas. Por ejemplo, diferentes mezclas de Alcohol en Agua (cambia la densidad final); un método para volverlas a separar es po
Un ejemplo común podría ser un sólido disuelto en un líquido, como la sal o el azúcar disuelto en agua; o incluso el oro en mercurio, formando una amalgama.
Disolvente y soluto
Características generales
Gaseosas
Sólidos en Gases: Existen infinidad de disoluciones de este tipo, pues las podemos encontrar en la contaminación al estudiar los componentes del humo por ejemplo, se encontrará que hay varios minerales disueltos en gases.
Gases en Gases: De igual manera, existe una gran variedad de disoluciones de gases con gases en la atmósfera, como el Oxígeno en Nitrógeno.
Líquidos en Gases: Este tipo de disoluciones se encuentran en las nieblas.
Son mezclas homogéneas: las proporciones relativas de solutos y solvente se mantienen en cualquier cantidad que tomemos de la disolución (por pequeña que sea la gota), y no se pueden separar por centrifugación ni filtración.
Al disolver una sustancia, el volumen final es diferente a la suma de los volúmenes del disolvente y el soluto.4
La cantidad de soluto y la cantidad de disolvente se encuentran en proporciones que varían entre ciertos límites. Normalmente el disolvente se encuentra en mayor proporción que el soluto, aunque no siempre es así. La proporción en que tengamos el soluto en el seno del disolvente depende del tipo de interacción que se produzca entre ellos. Esta interacción está relacionada con la solubilidad del soluto en el disolvente.
Las propiedades físicas de la solución son diferentes a las del solvente puro: la adición de un soluto a un solvente aumenta su punto de ebullición y disminuye su punto de congelación; la adición de un soluto a un solvente disminuye la presión de vapor de éste.
Sus propiedades físicas dependen de su concentración:
Disolución HCl 12 mol/L Densidad = 1,18 g/cm3
Disolución HCl 6 mol/L Densidad = 1,10 g/cm3
Las propiedades químicas de los componentes de una disolución no se alteran.
Sus componentes se separan por cambios de fases, como la fusión, evaporación, condensación, etc.
Tienen ausencia de sedimentación, es decir, al someter una disolución a un proceso de centrifugación las partículas del soluto no sedimentan debido a que el tamaño de las mismas son inferiores a 10 Angstrom ( Å ).
Se encuentran en una sola fase.
Frecuentemente, uno de los componentes es denominado disolvente, solvente, dispersante o medio de dispersión y los demás solutos. Los criterios para decidir cuál es el disolvente y cuáles los solutos son más o menos arbitrarios; no hay una razón científica para hacer tal distinción.1
Se suele llamar disolvente al componente que tiene el mismo estado de agregación que la disolución; y soluto o solutos, al otro u otros componentes. Si todos tienen el mismo estado, se llama disolvente al componente que interviene en mayor proporción de masa,2 aunque muchas veces se considera disolvente al que es más frecuentemente usado como tal (por ejemplo, una disolución conteniendo 50% de etanol y 50% de agua, es denominada solución acuosa de etanol).1 En el caso de dos metales disueltos mutuamente en estado sólido, se considera disolvente a aquél cuya estructura cristalina persiste en la solución; si ambos tienen la misma estructura (ej.: aleaciones paladio-plata), se considera disolvente al metal que ocupa la mayoría de las posiciones en la estructura cristalina.3
Wilhelm Ostwald distingue tres tipos de mezclas según el tamaño de las partículas de soluto en la disolución:2
Dispersiones, suspensiones o falsas disoluciones: cuando el diámetro de las partículas de soluto excede de 0,1 μm
Dispersoides, coloides o disoluciones coloidales: el tamaño está entre 0,001 μm y 0,1 μm
Dispérsidos o disoluciones verdaderas: el tamaño es menor a 0,001 μm
Estas últimas se clasifican en:
Disoluciones con condensación molecular: la partícula dispersa está formada por una condensación de moléculas.
Disoluciones moleculares: cada partícula es una molécula.
Disoluciones iónicas: la partícula dispersa es un ion (fracción de molécula con carga eléctrica).
Disoluciones atómicas: cada partícula dispersa es un átomo.
Líquidas
Sólidos en Líquidos: Este tipo de disoluciones es de las más utilizadas, pues se disuelven por lo general pequeñas cantidades de sustancias sólidas (solutos) en grandes cantidades líquidas (solventes). Ejemplos claros de este tipo son la mezcla del Agua con el Azúcar, también cuando se prepara un Té, o al agregar Sal a la hora de cocinar.
Gases en Líquidos: Por ejemplo, Oxígeno en Agua.
Líquidos en Líquidos: Ésta es otra de las disoluciones más utilizadas. Por ejemplo, diferentes mezclas de Alcohol en Agua (cambia la densidad final); un método para volverlas a separar es po
Líquidas
Sólidos en Líquidos: Este tipo de disoluciones es de las más utilizadas, pues se disuelven por lo general pequeñas cantidades de sustancias sólidas (solutos) en grandes cantidades líquidas (solventes). Ejemplos claros de este tipo son la mezcla del Agua con el Azúcar, también cuando se prepara un Té, o al agregar Sal a la hora de cocinar.
Gases en Líquidos: Por ejemplo, Oxígeno en Agua.
Líquidos en Líquidos: Ésta es otra de las disoluciones más utilizadas. Por ejemplo, diferentes mezclas de Alcohol en Agua (cambia la densidad final); un método para volverlas a separar es po
Estequiometría
En química, la estequiometría (del griego στοιχειον, stoicheion, 'elemento' y μετρον, métrón, 'medida') es el cálculo de las relaciones cuantitativas entre reactantes1 (o también conocidos como reactivos) y productos en el transcurso de una reacción química.2 Estas relaciones se pueden deducir a partir de la teoría atómica, aunque históricamente se enunciaron sin hacer referencia a la composición de la materia, según distintas leyes y principios.
El primero que enunció los principios de la estequiometría fue Jeremias Benjamin Richter (1762-1807), en 1792, quien describió la estequiometría de la siguiente manera:
La estequiometría es la ciencia que mide las proporciones cuantitativas o relaciones de masa en la que los elementos químicos que están implicados.
En una reacción química se observa una modificación de las sustancias presentes: los reactivos se consumen para dar lugar a los productos.
A escala microscópica, la reacción química es una modificación de los enlaces entre átomos, por desplazamientos de electrones: unos enlaces se rompen y otros se forman, pero los átomos implicados se conservan. Esto es lo que llamamos la ley de conservación de la masa, que implica las dos leyes siguientes:
la conservación del número de átomos de cada elemento químico
la conservación de la carga total
Las relaciones estequiométricas entre las cantidades de reactivos consumidos y productos formados dependen directamente de estas leyes de conservación, y están determinadas por la ecuación (ajustada) de la reacción.
Balance de materia
Una ecuación química es la representación escrita de una reacción química. Se dice que está ajustada o equilibrada cuando respeta la ley de conservación de la materia, según la cual la suma de los átomos de cada elemento debe ser igual en los reactivos y en los productos de la reacción. Para respetar estas reglas, se pone delante de cada especie química un número denominado coeficiente estequiométrico, que indica la proporción de cada especie involucrada.
Por ejemplo, en la reacción de combustión de metano (CH4), éste se combina con oxígeno molecular(O2) del aire para formar dióxido de carbono (CO2) y agua. (H2O). La reacción sin ajustar será:
En esta ecuación, las incógnitas son a, b, c y d, que son los denominados coeficientes estequiométricos. Para calcularlos, debe tenerse en cuenta la ley de conservación de la materia, por lo que la suma de los átomos cada elemento debe ser igual en los reactivos y en los productos de la reacción. En el ejemplo, para el elemento hidrógeno (H) hay 4·a átomos en los reactivos y 2·d átomos en los productos. De esta manera se obtiene un sistema de ecuaciones:
Hidrógeno: 4·a = 2·d
Oxígeno: 2·b = 2·c + d
Carbono: a=c
Obteniendo en este caso es un sistema de ecuaciones indeterminado, con tres ecuaciones y cuatro incógnitas. Para resolverlo, se asigna un valor a una de las variables, obteniendo así una cuarta ecuación, que no debe ser combinación lineal de las demás. Por ejemplo: a=1.
Sustituyendo a=1 en la primera ecuación del sistema de ecuaciones, se obtiene d=2.
Sustituyendo a=1 en la tercera ecuación, se obtiene c=1.
Sustituyendo c=1 y d=2 en la segunda ecuación, se obtiene b=2.
Sustituyendo los coeficientes estequimétricos en la ecuación de la reacción, se obtiene la ecuación ajustada de la reacción:
Ésta dice que 1 molécula de metano reacciona con 2 moléculas de oxígeno para dar 1 molécula de dióxido de carbono y 2 moléculas de agua.
Al fijar arbitrariamente un coeficiente e ir deduciendo los demás pueden obtenerse valores racionales no enteros. En este caso, se multiplican todos los coeficientes por el mínimo común múltiplo de los denominadores. En reacciones más complejas, como es el caso de las reacciones redox, se emplea el método del ion-electrón.
Mezcla, proporciones y condiciones estequiométricas
Cuando los reactivos de una reacción están en cantidades proporcionales a sus coeficientes estequiométricos se dice:
La mezcla es estequiométrica;
Los reactivos están en proporciones estequiométricas;
La reacción tiene lugar en condiciones estequiométricas;
Las tres expresiones tienen el mismo significado.
En estas condiciones, si la reacción es completa, todos los reactivos se consumirán dando las cantidades estequiométricas de productos correspondientes.
Si no en esta forma, existirá el reactivo limitante que es el que está en menor proporción y que con base en él se trabajan todos los cálculos.
El primero que enunció los principios de la estequiometría fue Jeremias Benjamin Richter (1762-1807), en 1792, quien describió la estequiometría de la siguiente manera:
La estequiometría es la ciencia que mide las proporciones cuantitativas o relaciones de masa en la que los elementos químicos que están implicados.
En una reacción química se observa una modificación de las sustancias presentes: los reactivos se consumen para dar lugar a los productos.
A escala microscópica, la reacción química es una modificación de los enlaces entre átomos, por desplazamientos de electrones: unos enlaces se rompen y otros se forman, pero los átomos implicados se conservan. Esto es lo que llamamos la ley de conservación de la masa, que implica las dos leyes siguientes:
la conservación del número de átomos de cada elemento químico
la conservación de la carga total
Las relaciones estequiométricas entre las cantidades de reactivos consumidos y productos formados dependen directamente de estas leyes de conservación, y están determinadas por la ecuación (ajustada) de la reacción.
Balance de materia
Una ecuación química es la representación escrita de una reacción química. Se dice que está ajustada o equilibrada cuando respeta la ley de conservación de la materia, según la cual la suma de los átomos de cada elemento debe ser igual en los reactivos y en los productos de la reacción. Para respetar estas reglas, se pone delante de cada especie química un número denominado coeficiente estequiométrico, que indica la proporción de cada especie involucrada.
Por ejemplo, en la reacción de combustión de metano (CH4), éste se combina con oxígeno molecular(O2) del aire para formar dióxido de carbono (CO2) y agua. (H2O). La reacción sin ajustar será:
En esta ecuación, las incógnitas son a, b, c y d, que son los denominados coeficientes estequiométricos. Para calcularlos, debe tenerse en cuenta la ley de conservación de la materia, por lo que la suma de los átomos cada elemento debe ser igual en los reactivos y en los productos de la reacción. En el ejemplo, para el elemento hidrógeno (H) hay 4·a átomos en los reactivos y 2·d átomos en los productos. De esta manera se obtiene un sistema de ecuaciones:
Hidrógeno: 4·a = 2·d
Oxígeno: 2·b = 2·c + d
Carbono: a=c
Obteniendo en este caso es un sistema de ecuaciones indeterminado, con tres ecuaciones y cuatro incógnitas. Para resolverlo, se asigna un valor a una de las variables, obteniendo así una cuarta ecuación, que no debe ser combinación lineal de las demás. Por ejemplo: a=1.
Sustituyendo a=1 en la primera ecuación del sistema de ecuaciones, se obtiene d=2.
Sustituyendo a=1 en la tercera ecuación, se obtiene c=1.
Sustituyendo c=1 y d=2 en la segunda ecuación, se obtiene b=2.
Sustituyendo los coeficientes estequimétricos en la ecuación de la reacción, se obtiene la ecuación ajustada de la reacción:
Ésta dice que 1 molécula de metano reacciona con 2 moléculas de oxígeno para dar 1 molécula de dióxido de carbono y 2 moléculas de agua.
Al fijar arbitrariamente un coeficiente e ir deduciendo los demás pueden obtenerse valores racionales no enteros. En este caso, se multiplican todos los coeficientes por el mínimo común múltiplo de los denominadores. En reacciones más complejas, como es el caso de las reacciones redox, se emplea el método del ion-electrón.
Mezcla, proporciones y condiciones estequiométricas
Cuando los reactivos de una reacción están en cantidades proporcionales a sus coeficientes estequiométricos se dice:
La mezcla es estequiométrica;
Los reactivos están en proporciones estequiométricas;
La reacción tiene lugar en condiciones estequiométricas;
Las tres expresiones tienen el mismo significado.
En estas condiciones, si la reacción es completa, todos los reactivos se consumirán dando las cantidades estequiométricas de productos correspondientes.
Si no en esta forma, existirá el reactivo limitante que es el que está en menor proporción y que con base en él se trabajan todos los cálculos.
Balanceo de Ecuaciones de Óxido Reducción
Se determinan los números de oxidación de cada uno de los elementos de las sustancias que intervienen en la reacción.
Se localizan a los elementos que cambian su número de oxidación y con ello se realizan semireacciones
Se balancean las dos semireacciones sin considerar la carga de los elementos
Se determinan en las semireacciones la que se óxida y la que se reduce
Se determina el número de electrones ganados y perdidos para esto se múltiplica la carga del elemento por el número de átomos tanto en los reactivos como en los productos y la diferencia entre ambos será el número de electrones
El número de electrones ganados y perdidos debe ser el mismo de no ser así se multiplican los números ganados en forma de cruz y por cada una de las partes de la semireacción
Una vez que se tiene el mismo número de electrones ganados y pérdidos se suman las dos semireacciones formando una sola reacción por lo que quedan determinados los coeficientes de los elementos que se oxidan y reducen
Se trasladan los coeficientes encontradis a la ecuación original cada uno en su respectiva sustancia y se procede a balancear en forma global dejando hasta el último los hidrogenos y oxigenos
Se localizan a los elementos que cambian su número de oxidación y con ello se realizan semireacciones
Se balancean las dos semireacciones sin considerar la carga de los elementos
Se determinan en las semireacciones la que se óxida y la que se reduce
Se determina el número de electrones ganados y perdidos para esto se múltiplica la carga del elemento por el número de átomos tanto en los reactivos como en los productos y la diferencia entre ambos será el número de electrones
El número de electrones ganados y perdidos debe ser el mismo de no ser así se multiplican los números ganados en forma de cruz y por cada una de las partes de la semireacción
Una vez que se tiene el mismo número de electrones ganados y pérdidos se suman las dos semireacciones formando una sola reacción por lo que quedan determinados los coeficientes de los elementos que se oxidan y reducen
Se trasladan los coeficientes encontradis a la ecuación original cada uno en su respectiva sustancia y se procede a balancear en forma global dejando hasta el último los hidrogenos y oxigenos
Reacciones de óxido reducción
Para que exista una reacción redox, en el sistema debe haber un elemento que ceda electrones y otro que los acepte:
El agente reductor es aquel elemento químico que suministra electrones de su estructura química al medio, aumentando su estado de oxidación, es decir; oxidándose.
El agente oxidante es el elemento químico que tiende a captar esos electrones, quedando con un estado de oxidación inferior al que tenía, es decir; reducido. 1
Cuando un elemento químico reductor cede electrones al medio se convierte en un elemento oxidado, y la relación que guarda con su precursor queda establecida mediante lo que se llama un par redox. Análogamente, se dice que cuando un elemento químico capta electrones del medio se convierte en un elemento reducido, e igualmente forma un par redox con su precursor reducido.
Principio de electroneutralidad
La oxidación es una reacción química muy poderosa donde un compuesto cede electrones, y por lo tanto aumenta su estado de oxidación.2 Se debe tener en cuenta que en realidad una oxidación o una reducción es un proceso por el cual cambia el estado de oxidación de un compuesto. Este cambio no significa necesariamente un intercambio de electrones. Suponer esto -que es un error común- implica que todos los compuestos formados mediante un proceso redox son iónicos, puesto que es en éstos compuestos donde sí se da un enlace iónico, producto de la transferencia de electrones.
Por ejemplo, en la reacción de formación del cloruro de hidrógeno a partir de los gases dihidrógeno y dicloruro, se da un proceso redox y sin embargo se forma un compuesto covalente.
Estas dos reacciones siempre se dan juntas, es decir, cuando una sustancia se oxida, siempre es por la acción de otra que se reduce. Una cede electrones y la otra los acepta. Por esta razón, se prefiere el término general de reacciones redox.
La propia vida es un fenómeno redox. El oxígeno es el mejor oxidante que existe debido a que la molécula es poco reactiva (por su doble enlace) y sin embargo es muy electronegativo, casi como el flúor.
La sustancia más oxidante que existe es el catión KrF+ porque fácilmente forma Kr y F+.
Entre otras, existen el permanganato de potasio (KMnO4), el óxido de cromo (VII) (Cr2O7), el agua oxigenada (H2O2), el ácido nítrico (HNO3), los hipohalitos y los halatos (por ejemplo el hipoclorito sódico (NaClO) muy oxidante en medio alcalino y el bromato potásico (KBrO3)). El ozono (O3) es un oxidante muy enérgico:
Br− + O3 → BrO3−
El nombre de "oxidación" proviene de que en la mayoría de estas reacciones, la transferencia de electrones se da mediante la adquisición de átomos de oxígeno (cesión de electrones) o viceversa. Sin embargo, la oxidación y la reducción puede darse sin que haya intercambio de oxígeno de por medio, por ejemplo, la oxidación de yoduro de sodio a yodo mediante la reducción de cloro a cloruro de sodio:
2 NaI + Cl2 → I2 + 2 NaCl
Esta puede desglosarse en sus dos semirreacciones correspondientes:
2I− → I2 + 2 e−
Cl2 + 2 e− → 2 Cl
Dentro de una reacción global redox, se da una serie de reacciones particulares a las cuales se les llama semirreacciones o reacciones parciales.
2 Na+ + 2 Cl− → 2 Na + Cl2
o más comúnmente:
2 NaCl → 2 Na + Cl2
La tendencia a reducir u oxidar a otros elementos químicos se cuantifica por el potencial de reducción, también llamado potencial redox.
Una titulación redox es una en la que un indicador químico indica el cambio en el porcentaje de la reacción redox mediante el viraje de color entre el oxidante y el reductor.
El agente reductor es aquel elemento químico que suministra electrones de su estructura química al medio, aumentando su estado de oxidación, es decir; oxidándose.
El agente oxidante es el elemento químico que tiende a captar esos electrones, quedando con un estado de oxidación inferior al que tenía, es decir; reducido. 1
Cuando un elemento químico reductor cede electrones al medio se convierte en un elemento oxidado, y la relación que guarda con su precursor queda establecida mediante lo que se llama un par redox. Análogamente, se dice que cuando un elemento químico capta electrones del medio se convierte en un elemento reducido, e igualmente forma un par redox con su precursor reducido.
Principio de electroneutralidad
La oxidación es una reacción química muy poderosa donde un compuesto cede electrones, y por lo tanto aumenta su estado de oxidación.2 Se debe tener en cuenta que en realidad una oxidación o una reducción es un proceso por el cual cambia el estado de oxidación de un compuesto. Este cambio no significa necesariamente un intercambio de electrones. Suponer esto -que es un error común- implica que todos los compuestos formados mediante un proceso redox son iónicos, puesto que es en éstos compuestos donde sí se da un enlace iónico, producto de la transferencia de electrones.
Por ejemplo, en la reacción de formación del cloruro de hidrógeno a partir de los gases dihidrógeno y dicloruro, se da un proceso redox y sin embargo se forma un compuesto covalente.
Estas dos reacciones siempre se dan juntas, es decir, cuando una sustancia se oxida, siempre es por la acción de otra que se reduce. Una cede electrones y la otra los acepta. Por esta razón, se prefiere el término general de reacciones redox.
La propia vida es un fenómeno redox. El oxígeno es el mejor oxidante que existe debido a que la molécula es poco reactiva (por su doble enlace) y sin embargo es muy electronegativo, casi como el flúor.
La sustancia más oxidante que existe es el catión KrF+ porque fácilmente forma Kr y F+.
Entre otras, existen el permanganato de potasio (KMnO4), el óxido de cromo (VII) (Cr2O7), el agua oxigenada (H2O2), el ácido nítrico (HNO3), los hipohalitos y los halatos (por ejemplo el hipoclorito sódico (NaClO) muy oxidante en medio alcalino y el bromato potásico (KBrO3)). El ozono (O3) es un oxidante muy enérgico:
Br− + O3 → BrO3−
El nombre de "oxidación" proviene de que en la mayoría de estas reacciones, la transferencia de electrones se da mediante la adquisición de átomos de oxígeno (cesión de electrones) o viceversa. Sin embargo, la oxidación y la reducción puede darse sin que haya intercambio de oxígeno de por medio, por ejemplo, la oxidación de yoduro de sodio a yodo mediante la reducción de cloro a cloruro de sodio:
2 NaI + Cl2 → I2 + 2 NaCl
Esta puede desglosarse en sus dos semirreacciones correspondientes:
2I− → I2 + 2 e−
Cl2 + 2 e− → 2 Cl
Dentro de una reacción global redox, se da una serie de reacciones particulares a las cuales se les llama semirreacciones o reacciones parciales.
2 Na+ + 2 Cl− → 2 Na + Cl2
o más comúnmente:
2 NaCl → 2 Na + Cl2
La tendencia a reducir u oxidar a otros elementos químicos se cuantifica por el potencial de reducción, también llamado potencial redox.
Una titulación redox es una en la que un indicador químico indica el cambio en el porcentaje de la reacción redox mediante el viraje de color entre el oxidante y el reductor.
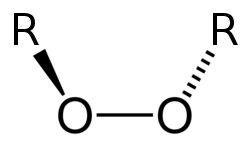
Peróxidos
s peróxidos son sustancias que presentan un enlace oxígeno-oxígeno y que contienen el oxígeno en estado de oxidación −1. Generalmente se comportan como sustancias oxidantes.
En contacto con material combustible pueden provocar incendios o incluso explosiones. Sin embargo frente a oxidantes fuertes como el permanganato pueden actuar como reductor oxidándose a oxígeno elemental. Es importante puntualizar que el peróxido tiene carga.
En pocas palabras son oxidos que presentan mayor cantidad de oxigeno que un oxido normal y en su estructura manifiestan un enlace covalente sencillo apolar
íntesis
El peróxido más conocido y principal compuesto de partida en la síntesis de otros peróxidos es el peróxido de hidrógeno (H2O2). Hoy en día se suele obtener por autooxidación de naftohidroquinona. Antiguamente se utilizaba la formación de peróxido de bario o la hidrólisis de persulfatos que a su vez se generaban por electrólisis de sulfatos en disolución acuosa con altas densidades de corriente por superficie del electrodo.
Muchas sustancias orgánicas pueden convertirse en hidroperóxidos en reacciones de autooxidación en presencia de luz y oxígeno atmosférico. Especialmente peligroso es la formación a partir de éteres ya que estos se transforman muy fácilmente y los peróxidos se suelen enriquecer en el residuo de una posterior destilación. Allí pueden producir explosiones muy fuertes. Muchos de los accidentes más trágicos de laboratorio se deben a este tipo de reacción. Por lo tanto antes de destilar cantidades mayores de estos disolventes hay que probar la presencia de peróxidos con papel impregnado de yoduro de potasio y almidón. La formación de un color azulado u oscuro indica la presencia de peróxido. (El peróxido oxida el yoduro a yodo elemental que, a su vez, forma con el almidón un complejo de inclusión del color característico oscuro).
Presencia
Los peróxidos se forman en pequeñas dosis en muchos procesos de oxidación vegetal. Para evitar su acumulación a concentraciones dañinas los organismos suelen disponer de una enzima, la catalasa, que cataliza la dismutación del peróxido de hidrógeno en agua y oxígeno elemental.
Aplicaciones
Las aplicaciones de los peróxidos son muy versátiles. Pasan de la peluquería donde se emplean en tintes para aclarar el pelo hasta en combustibles de cohetes. En la industria química se utilizan en la obtención de los epóxidos, en diversas reacciones de oxidación, como iniciadores de reacciones radicalarias por ejemplo para endurecer poliésteres o en la fabricación del glicerol a partir del alcohol hidroxipropénico. El ácido peroxotrifluoroacético (F3C–C(=O)–O–O–H) es un desinfectante muy potente y se emplea como tal en la industria farmacéutica. En odontología se utiliza para el blanqueamiento de los dientes, ya sea aplicado en gel o en bandas impregandas de peróido en concentraciones de 9%, 16% y 25%.
En contacto con material combustible pueden provocar incendios o incluso explosiones. Sin embargo frente a oxidantes fuertes como el permanganato pueden actuar como reductor oxidándose a oxígeno elemental. Es importante puntualizar que el peróxido tiene carga.
En pocas palabras son oxidos que presentan mayor cantidad de oxigeno que un oxido normal y en su estructura manifiestan un enlace covalente sencillo apolar
íntesis
El peróxido más conocido y principal compuesto de partida en la síntesis de otros peróxidos es el peróxido de hidrógeno (H2O2). Hoy en día se suele obtener por autooxidación de naftohidroquinona. Antiguamente se utilizaba la formación de peróxido de bario o la hidrólisis de persulfatos que a su vez se generaban por electrólisis de sulfatos en disolución acuosa con altas densidades de corriente por superficie del electrodo.
Muchas sustancias orgánicas pueden convertirse en hidroperóxidos en reacciones de autooxidación en presencia de luz y oxígeno atmosférico. Especialmente peligroso es la formación a partir de éteres ya que estos se transforman muy fácilmente y los peróxidos se suelen enriquecer en el residuo de una posterior destilación. Allí pueden producir explosiones muy fuertes. Muchos de los accidentes más trágicos de laboratorio se deben a este tipo de reacción. Por lo tanto antes de destilar cantidades mayores de estos disolventes hay que probar la presencia de peróxidos con papel impregnado de yoduro de potasio y almidón. La formación de un color azulado u oscuro indica la presencia de peróxido. (El peróxido oxida el yoduro a yodo elemental que, a su vez, forma con el almidón un complejo de inclusión del color característico oscuro).
Presencia
Los peróxidos se forman en pequeñas dosis en muchos procesos de oxidación vegetal. Para evitar su acumulación a concentraciones dañinas los organismos suelen disponer de una enzima, la catalasa, que cataliza la dismutación del peróxido de hidrógeno en agua y oxígeno elemental.
Aplicaciones
Las aplicaciones de los peróxidos son muy versátiles. Pasan de la peluquería donde se emplean en tintes para aclarar el pelo hasta en combustibles de cohetes. En la industria química se utilizan en la obtención de los epóxidos, en diversas reacciones de oxidación, como iniciadores de reacciones radicalarias por ejemplo para endurecer poliésteres o en la fabricación del glicerol a partir del alcohol hidroxipropénico. El ácido peroxotrifluoroacético (F3C–C(=O)–O–O–H) es un desinfectante muy potente y se emplea como tal en la industria farmacéutica. En odontología se utiliza para el blanqueamiento de los dientes, ya sea aplicado en gel o en bandas impregandas de peróido en concentraciones de 9%, 16% y 25%.
Hidruros
Los hidruros son compuestos binarios formados por átomos de hidrógeno y de otro elemento (pudiendo ser este, metal o no metal). Existen dos tipos de hidruros: los metálicos y los hidrácidos.
Estado de oxidación
En un hidruro el estado de oxidación del Hidrógeno es -1
Hidruros de los no metales de carácter ácido
Se formulan escribiendo primero el símbolo del hidrógeno y después el del elemento. A continuación se intercambian las valencias. Los elementos como el azufre, selenio y telurio se combinan con el hidrógeno con valencia 2, y los elementos como el flúor, cloro, bromo y yodo, con valencia 1.
Se nombran añadiendo la terminación uro en la raíz del nombre del no-metal y especificando, a continuación, de hidrógeno:
HF → flúoruro de hidrógeno
HCl → cloruro de hidrógeno
HBr → bromuro de hidrógeno
HI → yoduro de hidrógeno
H2S → sulfuro de hidrógeno
H2Se → selenuro de hidrógeno
H2Te → teleluro de hidrógenoOtros hidruros de no metales
Se formulan indicando primero el símbolo del elemento y luego el del hidrógeno. A continuación, se intercambian las valencias.
Todos estos compuestos reciben nombres tradicionales admitidos por la IUPAC, y son los que habitualmente utilizan los químicos. Los más importantes son:
NH 3 →amoníaco
CH4 →metano
Hidruros de los metales
Se formulan escribiendo primero el símbolo del elemento metálico
Se nombran con la palabra hidruro seguida del nombre de metal.
Ejemplo:
LIH →hidruro de litio
CaH2 →hidruro de calcio
SrH2 →hidruro de estroncio
Estado de oxidación
En un hidruro el estado de oxidación del Hidrógeno es -1
Hidruros de los no metales de carácter ácido
Se formulan escribiendo primero el símbolo del hidrógeno y después el del elemento. A continuación se intercambian las valencias. Los elementos como el azufre, selenio y telurio se combinan con el hidrógeno con valencia 2, y los elementos como el flúor, cloro, bromo y yodo, con valencia 1.
Se nombran añadiendo la terminación uro en la raíz del nombre del no-metal y especificando, a continuación, de hidrógeno:
HF → flúoruro de hidrógeno
HCl → cloruro de hidrógeno
HBr → bromuro de hidrógeno
HI → yoduro de hidrógeno
H2S → sulfuro de hidrógeno
H2Se → selenuro de hidrógeno
H2Te → teleluro de hidrógenoOtros hidruros de no metales
Se formulan indicando primero el símbolo del elemento y luego el del hidrógeno. A continuación, se intercambian las valencias.
Todos estos compuestos reciben nombres tradicionales admitidos por la IUPAC, y son los que habitualmente utilizan los químicos. Los más importantes son:
NH 3 →amoníaco
CH4 →metano
Hidruros de los metales
Se formulan escribiendo primero el símbolo del elemento metálico
Se nombran con la palabra hidruro seguida del nombre de metal.
Ejemplo:
LIH →hidruro de litio
CaH2 →hidruro de calcio
SrH2 →hidruro de estroncio
No metales
No metales se denomina a los elementos químicos que no son metales. Los no metales, excepto el hidrógeno, están situados en la tabla periódica de los elementos en el bloque p. Los elementos de este bloque son no-metales, excepto los metaloides (B, Si, Ge, As, Sb, Te), todos los gases nobles (He, Ne, Ar, Kr, Xe, Rn), y algunos metales (Al, Ga,In, Tl, Sn, Pb).
Los no-metales aparecen en color verde, a la derecha de la tabla periódica.
En orden de número atómico:
Hidrógeno (H)
Carbono (C)
Nitrógeno (N)
Oxígeno (O)
Flúor (F)
Fósforo (P)
Azufre (S)
Cloro (Cl)
Selenio (Se)
Bromo (Br)
Yodo (I)
Astato (At)
Las propiedades de los no metales son, entre otras, Son malos conductores de electricidad y de calor. No tienen lustre. Por su fragilidad no pueden ser estirados en hilos ni aplanados en laminas.
El hidrógeno normalmente se sitúa encima de los metales alcalinos, pero normalmente se comporta como un no metal. Un no metal suele ser aislante o semiconductor de la electricidad. Los no metales suelen formar enlaces iónicos con los metales, ganando electrones, o enlaces covalentes con otros no metales, compartiendo electrones. Sus óxidos son ácidos.
Los no metales forman la mayor parte de la tierra, especialmente las capas más externas, y los organismos están compuestos en su mayor parte por no metales. Algunos no metales, en condiciones normales, son diatómicos en el estado elemental: hidrógeno (H2), nitrógeno (N2), oxígeno (O2), flúor (F2), cloro (Cl2), bromo (Br2) y yodo (I2). Los no metales varían mucho en su apariencia no son lustrosos y por lo general son malos conductores del calor y la electricidad. Sus puntos de fusión son más bajos que los de los metales (aunque el diamante, una forma de carbono, se funde a 3570 ºC). Varios no metales existen en condiciones ordinarias como moléculas diatómicas. En esta lista están incluidos cinco gases (H2, N2, 02, F2 y C12), un líquido (Br2) y un sólido volátil (I2). El resto de los no metales son sólidos que pueden ser duros como el diamante o blandos como el azufre. Al contrario de los metales, son muy frágiles y no pueden estirarse en hilos ni en láminas. Se encuentran en los tres estados de la materia a temperatura ambiente: son gases (como el oxígeno), líquidos (bromo) y sólidos (como el carbono). No tienen brillo metálico y no reflejan la luz. Muchos no metales se encuentran en todos los seres vivos: carbono, hidrógeno, oxígeno, nitrógeno, fósforo y azufre en cantidades importantes. Otros son oligoelementos: flúor, silicio, arsénico, yodo, cloro.
Los no-metales aparecen en color verde, a la derecha de la tabla periódica.
En orden de número atómico:
Hidrógeno (H)
Carbono (C)
Nitrógeno (N)
Oxígeno (O)
Flúor (F)
Fósforo (P)
Azufre (S)
Cloro (Cl)
Selenio (Se)
Bromo (Br)
Yodo (I)
Astato (At)
Las propiedades de los no metales son, entre otras, Son malos conductores de electricidad y de calor. No tienen lustre. Por su fragilidad no pueden ser estirados en hilos ni aplanados en laminas.
El hidrógeno normalmente se sitúa encima de los metales alcalinos, pero normalmente se comporta como un no metal. Un no metal suele ser aislante o semiconductor de la electricidad. Los no metales suelen formar enlaces iónicos con los metales, ganando electrones, o enlaces covalentes con otros no metales, compartiendo electrones. Sus óxidos son ácidos.
Los no metales forman la mayor parte de la tierra, especialmente las capas más externas, y los organismos están compuestos en su mayor parte por no metales. Algunos no metales, en condiciones normales, son diatómicos en el estado elemental: hidrógeno (H2), nitrógeno (N2), oxígeno (O2), flúor (F2), cloro (Cl2), bromo (Br2) y yodo (I2). Los no metales varían mucho en su apariencia no son lustrosos y por lo general son malos conductores del calor y la electricidad. Sus puntos de fusión son más bajos que los de los metales (aunque el diamante, una forma de carbono, se funde a 3570 ºC). Varios no metales existen en condiciones ordinarias como moléculas diatómicas. En esta lista están incluidos cinco gases (H2, N2, 02, F2 y C12), un líquido (Br2) y un sólido volátil (I2). El resto de los no metales son sólidos que pueden ser duros como el diamante o blandos como el azufre. Al contrario de los metales, son muy frágiles y no pueden estirarse en hilos ni en láminas. Se encuentran en los tres estados de la materia a temperatura ambiente: son gases (como el oxígeno), líquidos (bromo) y sólidos (como el carbono). No tienen brillo metálico y no reflejan la luz. Muchos no metales se encuentran en todos los seres vivos: carbono, hidrógeno, oxígeno, nitrógeno, fósforo y azufre en cantidades importantes. Otros son oligoelementos: flúor, silicio, arsénico, yodo, cloro.
Número de Oxidación
Oxidación:
La oxidación es una reacción química donde un metal o un no metal cede electrones, y por tanto aumenta su estado de oxidación. La reacción química opuesta a la oxidación se conoce como reducción, es decir cuando una especie química acepta electrones. Estas dos reacciones siempre se dan juntas, es decir, cuando una sustancia se oxida, siempre es por la acción de otra que se reduce. Una cede electrones y la otra los acepta. Por esta razón, se prefiere el término general de reacciones redox. El oxígeno es el mejor oxidante que existe debido a que la molécula es poco reactiva (por su doble enlace) y sin embargo es muy electronegativo, casi como el flúor.
Tipos de oxidación
•Oxidación lenta
◦La que ocurre casi siempre en los metales a causa del agua o aire, causando su corrosión y pérdida de brillo y otras propiedades características de los metales, desprendiendo cantidades de calor inapreciables; al fundir un metal se acelera la oxidación, pero el calor proviene principalmente de la fuente que derritió el metal y no del proceso químico (una excepción sería el aluminio en la soldadura autógena).
•Oxidación rápida
◦La que ocurre durante lo que ya sería la combustión, desprendiendo cantidades apreciables de calor, en forma de fuego, y ocurre principalmente en substancias que contienen carbono e hidrógeno, (Hidrocarburos)
Combinaciones
Cuando el oxígeno se combina con un metal, puede formar o bien óxidos básicos o peróxidos, estos óxidos se caracterizan por ser de tipo básicos.
Si se combina el oxígeno con un no metal forma óxidos ácidos también llamados anhídridos y caracterizados por ser de tipo ácido (actúan como ácido).
La oxidación es una reacción química donde un metal o un no metal cede electrones, y por tanto aumenta su estado de oxidación. La reacción química opuesta a la oxidación se conoce como reducción, es decir cuando una especie química acepta electrones. Estas dos reacciones siempre se dan juntas, es decir, cuando una sustancia se oxida, siempre es por la acción de otra que se reduce. Una cede electrones y la otra los acepta. Por esta razón, se prefiere el término general de reacciones redox. El oxígeno es el mejor oxidante que existe debido a que la molécula es poco reactiva (por su doble enlace) y sin embargo es muy electronegativo, casi como el flúor.
Tipos de oxidación
•Oxidación lenta
◦La que ocurre casi siempre en los metales a causa del agua o aire, causando su corrosión y pérdida de brillo y otras propiedades características de los metales, desprendiendo cantidades de calor inapreciables; al fundir un metal se acelera la oxidación, pero el calor proviene principalmente de la fuente que derritió el metal y no del proceso químico (una excepción sería el aluminio en la soldadura autógena).
•Oxidación rápida
◦La que ocurre durante lo que ya sería la combustión, desprendiendo cantidades apreciables de calor, en forma de fuego, y ocurre principalmente en substancias que contienen carbono e hidrógeno, (Hidrocarburos)
Combinaciones
Cuando el oxígeno se combina con un metal, puede formar o bien óxidos básicos o peróxidos, estos óxidos se caracterizan por ser de tipo básicos.
Si se combina el oxígeno con un no metal forma óxidos ácidos también llamados anhídridos y caracterizados por ser de tipo ácido (actúan como ácido).
Reglas para asignar números de oxidación
Todos los elementos en estado natural o no combinados tienen un número de oxidación igual a cero.
Todos los elementos del grupo IA, en sus compuestos tienen un número de oxidación 1+
Todos los elementos del grupo IIA en sus compuestos tendran un número de oxidación 2+
El hidrogeno en sus compuestos tendra un número de oxidación 1+ excepto cuyo número de oxidación es 1- en hidruros.
El oxígeno en sus compuestos tiene número de oxidación 2- excepto en peróxidos cuyo número de oxidación e 1- .
Para descargar los ejercicios referentes a este tema pulsa aquí para descargar
Todos los elementos del grupo IA, en sus compuestos tienen un número de oxidación 1+
Todos los elementos del grupo IIA en sus compuestos tendran un número de oxidación 2+
El hidrogeno en sus compuestos tendra un número de oxidación 1+ excepto cuyo número de oxidación es 1- en hidruros.
El oxígeno en sus compuestos tiene número de oxidación 2- excepto en peróxidos cuyo número de oxidación e 1- .
Para descargar los ejercicios referentes a este tema pulsa aquí para descargar
IUPAC
La Nomenclatura IUPAC es un sistema de nomenclatura de compuestos químicos y de descripción de la ciencia y de la química en general.
Está desarrollado y actualizado bajo el patrocinio de la Unión Internacional de Química Pura y Aplicada.
Las reglas para nombrar compuestos orgánicos e inorgánicos están contenidas en dos publicaciones, conocidas como el Libro Azul y el Libro Rojo, respectivamente. Una tercera publicación, conocida como el Libro Verde, describe las recomendaciones para el uso de símbolos para cantidades físicas (en asociación con la IUPAP), mientras que el cuarto, el Libro Dorado, contiene las definiciones de un gran número de términos técnicos usados en química. Una compilación similar existe para la bioquímica (en asociación con el IUBMB), el análisis químico y la química macromolecular. Estos libros están complementados por unas cortas recomendaciones para circunstancias específicas las cuales son publicadas de vez en cuando en la Revista de Química Pura y Aplicada.
Objetivos de la nomenclatura química
La función principal de la nomenclatura química es asegurar que la persona que oiga o lea un nombre químico no albergue ninguna duda sobre el compuesto químico en cuestión, es decir, cada nombre debería referirse a una sola sustancia. Se considera menos importante asegurar que cada sustancia tenga un solo nombre, aunque el número de nombres aceptables es limitado.
Es también preferible que un nombre traiga algo de información sobre la estructura o la química de un componente. Los números CAS forman un ejemplo extremo de nombre que no toman en cuenta estas recomendaciones: cada uno se refiere a un componente en particular pero no contiene información de la estructura.
Silicato
os silicatos son el grupo de minerales de mayor abundancia, pues constituyen más del 95% de la corteza terrestre, además del grupo de más importancia geológica por ser petrogénicos, es decir, los minerales que forman las rocas. Todos los silicatos están compuestos por silicio y oxígeno. Estos elementos pueden estar acompañados de otros entre los que destacan aluminio, hierro, magnesio o calcio.
Químicamente son sales del ácido silícico. Los silicatos, así como los aluminosilicatos, son la base de numerosos minerales que tienen al tetraedro de silicio-oxígeno (un átomo de silicio coordinado tetraédricamente a átomos de oxígeno) como su estructura básica: feldespatos, micas, arcillas.
Los silicatos forman materiales basados en la repetición de la unidad tetraédrica SiO44-. La unidad SiO44- tiene cargas negativas que generalmente son compensadas por la presencia de iones de metales alcalinos o alcalinotérreos, así como de otros metales como el aluminio.
Los silicatos forman parte de la mayoría de las rocas, arenas y arcillas. También se puede obtener vidrio a partir de muchos silicatos. Los átomos de oxígeno pueden compartirse entre dos de estas unidades SiO44-, es decir, se comparte uno de los vértices del tetraedro. Por ejemplo, el disilicato tiene como fórmula [Si2O5]6- y, en general, los silicatos tiene como fórmula [(SiO3)2-]n.
En el caso de que todos los átomos de oxígeno estén compartidos, y por tanto la carga está neutralizada, se tiene una red tridimensional denominada sílice o dióxido de silicio, SiO2.
En los aluminosilicatos un átomo de silicio es sustituido por uno de aluminio.
Clasificación
Las propiedades de los silicatos dependen más de la estructura cristalina en que se disponen sus átomos que de los elementos químicos que constituyen su fórmula. Más concretamente, dependen de la forma en que se dispone y enlaza con los iones la unidad fundamental de los silicatos, el tetraedro de (SiO4)4-.
La diferencia entre los distintos grupos es la forma en que estos tetraedros se unen. Se distinguen así las siguientes subclases:
Nesosilicatos: Con tetraedros sueltos, de forma que cada valencia libre del tetraedro queda saturada por un catión distinto del silicio. Sus fórmulas serán (SiO4)4-. Se agrupan en:
Zircón
Olivino
Granate
Nesosubsilicatos
Sorosilicatos: Con dos tetradros unidos por un vértice para formar un grupo (Si2O7)6-. Se agrupan en:
Epidota
Melilita
Torveitita
Hemimorfita
Lawsonita
Ciclosilicatos: Con grupos de tres, cuatro o seis tetraedros, unidos en anillo. Se agrupan en:
Tetraedrita
Turmalina
Variedades de la turmalina, chorlo, dravita, indigolita, lidicoaita, elbaita, rubelita
Berilo
Variedades del berilo, esmeralda,morganita,
Cordierita
Dioptasa
Inosilicatos: Con grupos de tetraedros unidos en largas cadenas de longitud indefinida. Los más comunes son los que presentan cadenas simples, los llamados piroxenos, mientras que los llamados anfíboles tienen cadenas dobles. Esta estructura dota a estos minerales de hábito fibroso. Se agrupan en:
Piroxeno
Anfíbol
Piroxenoide
Anfiboloide
Filosilicatos: Con tetraedros unidos por tres vértices a otros, formando una red plana que se extiende en un plano de dimensiones indefinidas. Esta estructura dota a estos silicatos de hábito foliado. Se agrupan en:
Clorita
Micas
Talco
Pirofilita
Serpentinas
Caolinita
Tectosilicatos: Con tetraedros unidos por sus cuatro vértices a otros tetraedros, produciendo una malla de extensión tridimensional, compleja. La sustitución de silicio por aluminio en algunos tetraedros permite que en la malla se coloquen cationes. Se agrupan en:
Cuarzo
Tridimita
Cristobalita
Feldespatos
Zeolita
Escapolita
Químicamente son sales del ácido silícico. Los silicatos, así como los aluminosilicatos, son la base de numerosos minerales que tienen al tetraedro de silicio-oxígeno (un átomo de silicio coordinado tetraédricamente a átomos de oxígeno) como su estructura básica: feldespatos, micas, arcillas.
Los silicatos forman materiales basados en la repetición de la unidad tetraédrica SiO44-. La unidad SiO44- tiene cargas negativas que generalmente son compensadas por la presencia de iones de metales alcalinos o alcalinotérreos, así como de otros metales como el aluminio.
Los silicatos forman parte de la mayoría de las rocas, arenas y arcillas. También se puede obtener vidrio a partir de muchos silicatos. Los átomos de oxígeno pueden compartirse entre dos de estas unidades SiO44-, es decir, se comparte uno de los vértices del tetraedro. Por ejemplo, el disilicato tiene como fórmula [Si2O5]6- y, en general, los silicatos tiene como fórmula [(SiO3)2-]n.
En el caso de que todos los átomos de oxígeno estén compartidos, y por tanto la carga está neutralizada, se tiene una red tridimensional denominada sílice o dióxido de silicio, SiO2.
En los aluminosilicatos un átomo de silicio es sustituido por uno de aluminio.
Clasificación
Las propiedades de los silicatos dependen más de la estructura cristalina en que se disponen sus átomos que de los elementos químicos que constituyen su fórmula. Más concretamente, dependen de la forma en que se dispone y enlaza con los iones la unidad fundamental de los silicatos, el tetraedro de (SiO4)4-.
La diferencia entre los distintos grupos es la forma en que estos tetraedros se unen. Se distinguen así las siguientes subclases:
Nesosilicatos: Con tetraedros sueltos, de forma que cada valencia libre del tetraedro queda saturada por un catión distinto del silicio. Sus fórmulas serán (SiO4)4-. Se agrupan en:
Zircón
Olivino
Granate
Nesosubsilicatos
Sorosilicatos: Con dos tetradros unidos por un vértice para formar un grupo (Si2O7)6-. Se agrupan en:
Epidota
Melilita
Torveitita
Hemimorfita
Lawsonita
Ciclosilicatos: Con grupos de tres, cuatro o seis tetraedros, unidos en anillo. Se agrupan en:
Tetraedrita
Turmalina
Variedades de la turmalina, chorlo, dravita, indigolita, lidicoaita, elbaita, rubelita
Berilo
Variedades del berilo, esmeralda,morganita,
Cordierita
Dioptasa
Inosilicatos: Con grupos de tetraedros unidos en largas cadenas de longitud indefinida. Los más comunes son los que presentan cadenas simples, los llamados piroxenos, mientras que los llamados anfíboles tienen cadenas dobles. Esta estructura dota a estos minerales de hábito fibroso. Se agrupan en:
Piroxeno
Anfíbol
Piroxenoide
Anfiboloide
Filosilicatos: Con tetraedros unidos por tres vértices a otros, formando una red plana que se extiende en un plano de dimensiones indefinidas. Esta estructura dota a estos silicatos de hábito foliado. Se agrupan en:
Clorita
Micas
Talco
Pirofilita
Serpentinas
Caolinita
Tectosilicatos: Con tetraedros unidos por sus cuatro vértices a otros tetraedros, produciendo una malla de extensión tridimensional, compleja. La sustitución de silicio por aluminio en algunos tetraedros permite que en la malla se coloquen cationes. Se agrupan en:
Cuarzo
Tridimita
Cristobalita
Feldespatos
Zeolita
Escapolita
Ión
Un ion, también escrito ión,1 (‘el que va’, en griego; siendo ἰών [ión] el participio presente del verbo ienai: ‘ir’) es una partícula cargada constituida por un átomo o molécula que no es eléctricamente neutra. Conceptualmente esto se puede entender como que a partir de un estado neutro se han ganado o perdido electrones, y este fenómeno se conoce como ionización.
Los iones cargados negativamente, producidos por la ganancia de electrones, se conocen como aniones (que son atraídos por el ánodo) y los cargados positivamente, consecuencia de una pérdida de electrones, se conocen como cationes (los que son atraídos por el cátodo).
'Anión' y 'catión' significan:
Anión: "el que va hacia arriba". Tiene carga eléctrica negativa.
Catión: "el que va hacia abajo". Tiene carga eléctrica positiva.
'Ánodo' y 'cátodo' utilizan el sufijo '-odo', del griego odos (-οδος), que significa camino o vía.
Ánodo: "camino ascendente".
Cátodo: "camino descendente".
Un ion conformado por un solo átomo se denomina ion monoatómico, a diferencia de uno conformado por dos o más átomos, que se denomina ion poliatómico.
Energía de ionización
La energía necesaria para separar completamente el electrón más débilmente unido de la corteza electrónica de un átomo en su estado fundamental, y de tal manera que en el electrón arrancado no quede ninguna energía residual (ni potencial ni cinética) se denomina primera energía de ionización y el potencial eléctrico equivalente (es decir, la energía dividida por la carga de un único electrón) se conoce como el potencial de ionización. Estos términos también se emplean para describir la ionización de las moléculas y los sólidos, pero los valores no son constantes debido a que la ionización puede estar afectada por factores como: la temperatura, la química y la geometría superficial.
Las unidades del sistema internacional, (SI) para la energía de ionización son los J/mol, aunque se usan con más frecuencia los KJ/mol, cuando se refiere a cantidades molares y eV (electrón-voltio) cuando se refiere a átomos individuales.
Los iones cargados negativamente, producidos por la ganancia de electrones, se conocen como aniones (que son atraídos por el ánodo) y los cargados positivamente, consecuencia de una pérdida de electrones, se conocen como cationes (los que son atraídos por el cátodo).
'Anión' y 'catión' significan:
Anión: "el que va hacia arriba". Tiene carga eléctrica negativa.
Catión: "el que va hacia abajo". Tiene carga eléctrica positiva.
'Ánodo' y 'cátodo' utilizan el sufijo '-odo', del griego odos (-οδος), que significa camino o vía.
Ánodo: "camino ascendente".
Cátodo: "camino descendente".
Un ion conformado por un solo átomo se denomina ion monoatómico, a diferencia de uno conformado por dos o más átomos, que se denomina ion poliatómico.
Energía de ionización
La energía necesaria para separar completamente el electrón más débilmente unido de la corteza electrónica de un átomo en su estado fundamental, y de tal manera que en el electrón arrancado no quede ninguna energía residual (ni potencial ni cinética) se denomina primera energía de ionización y el potencial eléctrico equivalente (es decir, la energía dividida por la carga de un único electrón) se conoce como el potencial de ionización. Estos términos también se emplean para describir la ionización de las moléculas y los sólidos, pero los valores no son constantes debido a que la ionización puede estar afectada por factores como: la temperatura, la química y la geometría superficial.
Las unidades del sistema internacional, (SI) para la energía de ionización son los J/mol, aunque se usan con más frecuencia los KJ/mol, cuando se refiere a cantidades molares y eV (electrón-voltio) cuando se refiere a átomos individuales.
Radical
El término radical viene del latín radix (‘raíz’), por lo que significa ‘de raíz’ o ‘de base’, refiriéndose sobre todo a un punto de vista profundo, sustancial, más aún si es aplicado a alguna convicción, práctica, análisis o propuesta.
No se debe confundir con otras palabras similares, como fanático (extremista irracional), ortodoxo (extremista religioso) o reaccionario (extremismo de derechas).
Según el contexto radical puede significar:
En política:
Radical, alguna posición que busca ir al fondo o raíz de las cosas, como por ejemplo los anarquistas.
un miembro de alguno de los partidos llamados «radicales» (entre ellos, la Unión Cívica Radical, de Argentina).
En química, un radical o radical libre es una molécula (orgánica o inorgánica), en general extremadamente inestable y con gran poder reactivo, por poseer un electrón desapareado.
En matemática:
el n-ésimo radical o raíz de un número a, escrito como , que es el número cuya n-ésima potencia es a (ver también raíz cuadrada).
en teoría de anillos, el radical de un ideal es una forma de completar el ideal del anillo.
en teoría de números, el radical de un entero es el mayor entero libre de cuadrados que divide a ese número.
En la escritura china, un radical es un conjunto de trazos básicos en que se puede descomponer un carácter chino.
En mercadotecnia, un marketing radical es el cambio total de mercadeo tradicional. Teoría de Sam Hill y Glenn Rifkin.
No se debe confundir con otras palabras similares, como fanático (extremista irracional), ortodoxo (extremista religioso) o reaccionario (extremismo de derechas).
Según el contexto radical puede significar:
En política:
Radical, alguna posición que busca ir al fondo o raíz de las cosas, como por ejemplo los anarquistas.
un miembro de alguno de los partidos llamados «radicales» (entre ellos, la Unión Cívica Radical, de Argentina).
En química, un radical o radical libre es una molécula (orgánica o inorgánica), en general extremadamente inestable y con gran poder reactivo, por poseer un electrón desapareado.
En matemática:
el n-ésimo radical o raíz de un número a, escrito como , que es el número cuya n-ésima potencia es a (ver también raíz cuadrada).
en teoría de anillos, el radical de un ideal es una forma de completar el ideal del anillo.
en teoría de números, el radical de un entero es el mayor entero libre de cuadrados que divide a ese número.
En la escritura china, un radical es un conjunto de trazos básicos en que se puede descomponer un carácter chino.
En mercadotecnia, un marketing radical es el cambio total de mercadeo tradicional. Teoría de Sam Hill y Glenn Rifkin.
Anión
Un 'anión' es un ion con carga eléctrica negativa, es decir, con exceso de electrones. Los aniones se describen con un estado de oxidación negativo. hay dos tipos de aniones monoatómicos y poliatomicos:
ANIONES MONOATOMICOS: suelen corresponder a no metales que han ganado electrones completos su capa de valencia.
Tradicional: se nombran con la palabra ion seguido del nombre del no metal terminado en el sufijo uro.ejemplo: Compuestos Nombre Cl- ion de cloruro H- ion de hidruro S2- ion de sulfuro NH2- ion de amiduro CN- ion de cianuro
Sistemática: se nombran igual que la nomenclatura tradicional. Ejemplo: Compuestos Nombre Cl- ion de cloruro H- ion de hidruro S2- ion de sulfuro
ANIONES POLIATOMICOS: se pueden considerar como procedentes de una molécula que ha perdido protones.
Tradicional: se nombran con la palabra ion seguido del nombre del no metal terminado en ito si actúa con la valencia menor o en ato si actúa con la valencia mayor. Ejemplo: Compuesto Nombre SO42- ion de sulfato
Sistemática: se nombran como los acidos pero antepniendo la palabra ion y quitando “ de hidrogeno”.ejemplo: Compuesto Nombre SO42- ion tetraoxosulfato (VI) NO2- ion dioxonitrato (III) ClO4- ion tetraoxomanganato (VII)
ANIONES ACIDOS: proceden de un acido poliprotico que ha perdido parte de sus protones.
Tradicional: se nombran como el ion correspondiente pero anteponiendo el prefijo hidrogeno y usando prefijos multiplicativos cuando haya más de uno
Sistemática: se nombran como el ion correspondiente pero anteponiendo el prefijo hidrogeno con el prefijo multiplicativo correspondiente.Para un mejor entendimiento realizamos un esquema de clasificación puesto que no es una clasificación rígida.
Clase (A) Desprenden gases con acido clorhídrico o sulfúrico diluido. Carbonato, Bicarbonato, Sulfito, Tiosulfato, Sulfuro, Nitrito, Hipoclorito, Cianuro y Cianato.Están incluidos los del (I) con el agregado de los siguientes Floruro, Cloruro, Bromuro, Yoduro, Nitrato, Clorato, Perclorato, Bromato y Yodato, Borato *, Ferrocianuro, Ferricianuro, Tiocianato, formiato, Acetato, Oxalato , Tartrato y Citrato.
Clase (B) Reacciones de precipitación. Sulfato, Persulfato **, Fosfato, Fosfito, Hipofosfito, Arseniato, Arsenito, Silicato, Flousilicato, Salicilato, Benzoato y Succinato. Reacciones de oxidación y reducción en solución, Manganato, Permanganato de Potasio, Cromato y Dicromato. Marcha analítica de los aniones más comunes:Los aniones más frecuentes en un laboratorio no se pueden separar de forma tan clara como los cationes. La mayor parte de las veces se van a identificar de forma directa, mientras que otros se van a separar en grandes grupos precipitando con cationes y, a partir de estos precipitados, se identifican esos aniones. Sin embargo, en laboratorio es bastante más difícil analizar los aniones presentes que los cationes.Generalmente en el laboratorio la marcha analítica de aniones se hace primero eliminando todos los cationes existentes precipitando con NaOH o CO32-. A continuación se hacen tres ensayos preliminares
Las sales típicamente están formadas por cationes y aniones (aunque el enlace nunca es puramente iónico, siempre hay una contribución covalente)
ANIONES MONOATOMICOS: suelen corresponder a no metales que han ganado electrones completos su capa de valencia.
Tradicional: se nombran con la palabra ion seguido del nombre del no metal terminado en el sufijo uro.ejemplo: Compuestos Nombre Cl- ion de cloruro H- ion de hidruro S2- ion de sulfuro NH2- ion de amiduro CN- ion de cianuro
Sistemática: se nombran igual que la nomenclatura tradicional. Ejemplo: Compuestos Nombre Cl- ion de cloruro H- ion de hidruro S2- ion de sulfuro
ANIONES POLIATOMICOS: se pueden considerar como procedentes de una molécula que ha perdido protones.
Tradicional: se nombran con la palabra ion seguido del nombre del no metal terminado en ito si actúa con la valencia menor o en ato si actúa con la valencia mayor. Ejemplo: Compuesto Nombre SO42- ion de sulfato
Sistemática: se nombran como los acidos pero antepniendo la palabra ion y quitando “ de hidrogeno”.ejemplo: Compuesto Nombre SO42- ion tetraoxosulfato (VI) NO2- ion dioxonitrato (III) ClO4- ion tetraoxomanganato (VII)
ANIONES ACIDOS: proceden de un acido poliprotico que ha perdido parte de sus protones.
Tradicional: se nombran como el ion correspondiente pero anteponiendo el prefijo hidrogeno y usando prefijos multiplicativos cuando haya más de uno
Sistemática: se nombran como el ion correspondiente pero anteponiendo el prefijo hidrogeno con el prefijo multiplicativo correspondiente.Para un mejor entendimiento realizamos un esquema de clasificación puesto que no es una clasificación rígida.
Clase (A) Desprenden gases con acido clorhídrico o sulfúrico diluido. Carbonato, Bicarbonato, Sulfito, Tiosulfato, Sulfuro, Nitrito, Hipoclorito, Cianuro y Cianato.Están incluidos los del (I) con el agregado de los siguientes Floruro, Cloruro, Bromuro, Yoduro, Nitrato, Clorato, Perclorato, Bromato y Yodato, Borato *, Ferrocianuro, Ferricianuro, Tiocianato, formiato, Acetato, Oxalato , Tartrato y Citrato.
Clase (B) Reacciones de precipitación. Sulfato, Persulfato **, Fosfato, Fosfito, Hipofosfito, Arseniato, Arsenito, Silicato, Flousilicato, Salicilato, Benzoato y Succinato. Reacciones de oxidación y reducción en solución, Manganato, Permanganato de Potasio, Cromato y Dicromato. Marcha analítica de los aniones más comunes:Los aniones más frecuentes en un laboratorio no se pueden separar de forma tan clara como los cationes. La mayor parte de las veces se van a identificar de forma directa, mientras que otros se van a separar en grandes grupos precipitando con cationes y, a partir de estos precipitados, se identifican esos aniones. Sin embargo, en laboratorio es bastante más difícil analizar los aniones presentes que los cationes.Generalmente en el laboratorio la marcha analítica de aniones se hace primero eliminando todos los cationes existentes precipitando con NaOH o CO32-. A continuación se hacen tres ensayos preliminares
Las sales típicamente están formadas por cationes y aniones (aunque el enlace nunca es puramente iónico, siempre hay una contribución covalente)
Catión
Un catión es un ion ( sea átomo o molécula) con carga eléctrica positiva, es decir, ha perdido electrones. Los cationes se describen con un estado de oxidación positivo.
Las sales típicamente están formadas por cationes y aniones (aunque el enlace nunca es puramente iónico, siempre hay una contribución covalente).
]]es alcalinos y alcalinotérreos:
sodio
potasio
magnesio
calcio
Metales
Amoníaco
Las sales típicamente están formadas por cationes y aniones (aunque el enlace nunca es puramente iónico, siempre hay una contribución covalente).
]]es alcalinos y alcalinotérreos:
sodio
potasio
magnesio
calcio
Metales
Amoníaco
Tabla de Hidruros, hidróxidos, Nitratos, Sulfatos, Carbonatos, Fosfatos, Carbonatos, Fosfatos, Silicatos
Nota: No colocamos esta tabla directamente en el blog por que es muy grande para poderla poner aquí pero la ponemos a su disposición en descarga aquí
Molaridad
En química, la concentración molar (también llamada molaridad) es una medida de la concentración de un soluto en una disolución, o de alguna especie molecular, iónica, o atómica que se encuentra en un volumen dado. Sin embargo, en termodinámica la utilización de la concentración molar a menudo no es conveniente, porque el volumen de la mayor parte de las soluciones depende en parte de la temperatura, debido a la dilatación térmica. Este problema se resuelve normalmente introduciendo coeficientes o factores de corrección de la temperatura, o utilizando medidas de concentración independiente de la temperatura tales como la molalidad.
Descargar 5 problemas de molaridad aquí
Descargar 5 problemas de molaridad aquí
Práctica de la Industria Química
Para aprender un poco más sobre la industria química debemos saber que esta siendo dominada por un sistema capitalista y que el precio de venta al público es un precio muy distinto del que cuesta en realidad siguiendo con el tema en esta prática podremos observar de que esta hecho un robot se nos pidió que llevaramos cualquier objeto que se pudiera desarmar y observar de que esta hecho.
En este caso el robot de plástico estaba compuesto generalmente de distintos tipos de plástico por lo tanto nos dimos a la taréa de dividirlos en números el robot estaba compuesto de un cuerpo azul unos brazos rojos unas partes de color aluminio etc.
La masa total del robot fue 348.69
Su volumen total fue de 144.7
y los datos fueron estos
estos son los resultados de la práctica demostrando que las industrias dan a un precio muy alto ya que esto debería costar menos de lo que costo
tenemos la opción de descargar los datos de la tabla aquí
En este caso el robot de plástico estaba compuesto generalmente de distintos tipos de plástico por lo tanto nos dimos a la taréa de dividirlos en números el robot estaba compuesto de un cuerpo azul unos brazos rojos unas partes de color aluminio etc.
La masa total del robot fue 348.69
Su volumen total fue de 144.7
y los datos fueron estos
Número de Plástico/ o parte del robot | Masa total (gr) | Volumen (ml) | Porcentaje (masa) | Porcentaje (volumen) |
I | 110.4 | 65 | 31.5% | 45 |
II | 163.9 | 70 | 47% | 49 |
III | 18.05 | .7 | 5.1% | .4 |
IV | 2.94 | .5 | .84% | .3 |
V | 4.8 | 5 | 1.37% | 3 |
Metal | 47.2 | 3 | 13.5% | 2 |
Alambre | 1.4 | .5 | .69% | .3 |
estos son los resultados de la práctica demostrando que las industrias dan a un precio muy alto ya que esto debería costar menos de lo que costo
tenemos la opción de descargar los datos de la tabla aquí
Vídeo
El vídeo1 o video2 3 es la tecnología de la captación, grabación, procesamiento, almacenamiento, transmisión y reconstrucción por medios electrónicos digitales o analógicos de una secuencia de imágenes que representan escenas en movimiento. Etimológicamente la palabra video proviene del verbo latino video, vides, videre, que se traduce como el verbo ‘ver’. Se suele aplicar este termino a la señal de vídeo y muchas veces se la denomina «el vídeo» o «la vídeo» a modo de abreviatura del nombre completo de la misma.
La tecnología de vídeo fue desarrollada por primera vez para los sistemas de televisión, pero ha derivado en muchos formatos para permitir la grabación de vídeo de los consumidores y que además pueda ser visto a través de Internet.
En algunos países se llama así también a una grabación de imágenes y sonido en cinta magnética o en disco de láser (DVD), aunque con la aparición de estos últimos dicho término se identifica generalmente con las grabaciones anteriores en cinta magnética, del tipo VHS, BETAMAX.
Inicialmente la señal de vídeo está formada por un número de líneas agrupadas en varios cuadros y estos a la vez divididos en dos campos portan la información de luz y color de la imagen. El número de líneas, de cuadros y la forma de portar la información del color depende del estándar de televisión concreto. La amplitud de la señal de vídeo es de 1Vpp (1 voltio de pico a pico) estando la parte de la señal que porta la información de la imagen por encima de 0V y la de sincronismos por debajo el nivel de 0V. La parte positiva puede llegar hasta 0,7V para el nivel de blanco, correspondiendo a 0V el negro y los sincronismos son pulsos que llegan hasta -0,3V. En la actualidad hay multitud de estandares diferentes, especialmente en el ámbito informático.
La tecnología de vídeo fue desarrollada por primera vez para los sistemas de televisión, pero ha derivado en muchos formatos para permitir la grabación de vídeo de los consumidores y que además pueda ser visto a través de Internet.
En algunos países se llama así también a una grabación de imágenes y sonido en cinta magnética o en disco de láser (DVD), aunque con la aparición de estos últimos dicho término se identifica generalmente con las grabaciones anteriores en cinta magnética, del tipo VHS, BETAMAX.
Inicialmente la señal de vídeo está formada por un número de líneas agrupadas en varios cuadros y estos a la vez divididos en dos campos portan la información de luz y color de la imagen. El número de líneas, de cuadros y la forma de portar la información del color depende del estándar de televisión concreto. La amplitud de la señal de vídeo es de 1Vpp (1 voltio de pico a pico) estando la parte de la señal que porta la información de la imagen por encima de 0V y la de sincronismos por debajo el nivel de 0V. La parte positiva puede llegar hasta 0,7V para el nivel de blanco, correspondiendo a 0V el negro y los sincronismos son pulsos que llegan hasta -0,3V. En la actualidad hay multitud de estandares diferentes, especialmente en el ámbito informático.
Podcasting
El podcasting consiste en la distribución de archivos multimedia (normalmente audio o vídeo, que puede incluir texto como subtítulos y notas) mediante un sistema de redifusión (RSS) que permita suscribirse y usar un programa que lo descarga para que el usuario lo escuche en el momento que quiera. No es necesario estar suscrito para descargarlos.
Integrantes del Equipo
Luis Fernando Castillo Cortés
Liliana Sanchéz Hernandez
Gabriela Figueroa Cambron
Alan Gabriel Ivan Rivera Suarez
Liliana Sanchéz Hernandez
Gabriela Figueroa Cambron
Alan Gabriel Ivan Rivera Suarez
Suscribirse a:
Entradas (Atom)